痛风科普系列——食物与菌群对痛风的影响
痛风是一个古老的疾病,早在2500年前西医之父希波克拉底就曾发现了痛风与奢侈生活、饮食喝酒不节制有关系。后来发现痛风是由于高尿酸血症引起的一组临床综合征。随着经济快速发展和人群生活方式的明显改变,中国高尿酸血症和痛风患病率显著增高,高尿酸血症患者已占总人口13.3%,而痛风患病率在1%-3%,且逐年上升[1]。
痛风的患病率随年龄增加而增加,在男性人群中,40-49岁年龄段痛风的患病率最高,可能是由于40-49岁男性有更多的社会应酬,更易饮酒及摄食含高嘌呤的食物,从而使该年龄段男性痛风高发。而且男性患病率明显高于女性,男性痛风患病率为1.49%,女性为1.27%[2]。南方和沿海经济发达地区痛风发病率明显高于同期其他地区。可能与这些地区居民饮食摄入过多高嘌呤的海产品和大量饮酒等因素有关。我国青藏高原游牧地区人群痛风发病率也较高。可能是相较于内陆,藏族群众饮食中红肉类食物摄入量较多,此类食物中饱和脂肪酸含量高,可引起体内尿酸清除率降低,造成血尿酸水平升高,引起痛风发病。
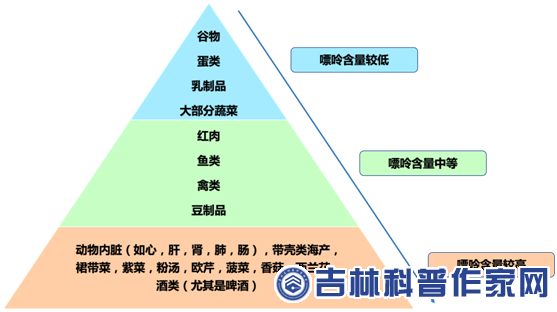
图表 1 常见食物的嘌呤含量(图表总结自文献)
Kaneko K, Aoyagi Y, Fukuuchi T, Inazawa K, Yamaoka N. Total purine and purine base content of common foodstuffs for facilitating nutritional therapy for gout and hyperuricemia. Biol Pharm Bull. 2014;37(5):709-21.
虽然痛风的主要特征是炎症性关节炎,但其主要的根本原因是高尿酸血症[3]。尿酸是人类嘌呤分解代谢的最终产物。嘌呤来源分析显示,体内近三分之二的嘌呤是内源性的,其余通过食物进入体内的嘌呤被称为外源性嘌呤。高尿酸血症引起的痛风被认为是与嘌呤相关的代谢性疾病。所有肉类和可食用植物都含有嘌呤,有些食物含有更高的浓度。因此,过度摄入高嘌呤饮食,包括海鲜和动物内脏,会引发嘌呤代谢物的过度积累,导致尿酸增加[4]。
许多研究表明,牛奶和酸奶与血清尿酸和痛风之间存在关联。由于乳制品的嘌呤含量低,乳制品蛋白可以发挥其降尿酸作用,而不会提供其他蛋白质来源(如肉类和海鲜)中所含的相应的嘌呤负荷。虽然乳制品中的其他营养素可能是导致负相关的因素,但目前没有相关的生物学或代谢证据[5]。
茶和咖啡是全球最常消费的饮料类型。咖啡因可以通过降低血清尿酸浓度来发挥对痛风患者的保护作用。咖啡可以通过其他机制降低痛风风险,例如,通过减少炎症反应、氧化应激、葡萄糖和胰岛素浓度以及胰岛素抵抗[6]。关于茶和痛风的关系,既往动物研究表明,绿茶中的成分可能会降低血清尿酸水平[7]。
酒精已被认为是增加血清尿酸和痛风发作的潜在风险因素。许多研究显示,酒精摄入量增加与高尿酸血症和痛风风险之间存在关联。长期和单次饮酒会导致血液中尿酸浓度的增加。在评估啤酒、白酒和葡萄酒的摄入量与血清尿酸水平之间的关系时显示:血清尿酸水平随着啤酒或白酒的摄入而增加。并且啤酒比白酒对血尿酸水平影响的增幅更大[8]。烧酒是一种日本蒸馏酒,也含有乙醇,由大麦、甘薯、大米或任何组合制成。对于烧酒的研究显示,与饮用啤酒和烧酒的受试者相比,高尿酸血症的风险没有统计学差异[9]。
水果含有果糖,摄入大量水果的人通常会减少精制糖的摄入量,因此整体的果糖摄入量可能很低。鉴于目前的知识,建议在管理痛风时减少精制糖和果汁,但鼓励摄入天然水果,果糖含量较低。水果对代谢健康的总体好处表明,当人们渴望吃甜食时,它将代表一种健康的选择[10]。大多数蔬菜仅含少量嘌呤,对尿酸、痛风的影响小,所有蔬菜中嘌呤总量的60%以上为腺嘌呤和鸟嘌呤[11]。而且蔬菜含有丰富的膳食纤维,膳食纤维可以增强饱腹感,控制食物的摄入量。同时蔬菜可以像水果一样提供丰富的维生素C,有助于痛风防治。蔬菜中的钾可以减少尿酸沉淀,有助于尿酸排出。
植物性蛋白质食物来源(如大豆食品和非大豆豆类)的摄入可以降低痛风风险[12]。在许多亚洲国家如日本、中国和新加坡,豆制品的摄入量占整个膳食蛋白摄入量的5%-10%。大豆和痛风之间的保护性关系,可能是通过促进体重减轻和增强尿酸代谢作用来介导的。

图表 2 肠道菌群与尿酸累积
Liu ZQ, Sun X, Liu ZB, Zhang T, Zhang LL, Wu CJ. Phytochemicals in traditional Chinese medicine can treat gout by regulating intestinal flora through inactivating NLRP3 and inhibiting XOD activity. J Pharm Pharmacol. 2022 Jul 15;74(7):919-929.
人类肠道中携带有数以万亿计的微生物,它们对于宿主健康至关重要。越来越多的证据表明,肠道菌群失调与代谢、免疫和神经系统疾病的发生有着密不可分的联系。肠道菌群在人类进化过程中逐渐形成动态平衡,与经济水平、饮食习惯、营养结构等有关,而当经济水平改变带来食物结构变化时,肠道菌群会相应改变,出现肠道菌群失衡,对高尿酸血症甚至痛风造成重要影响。痛风的代谢物可能会发生炎症,嘌呤代谢和尿酸排泄紊乱。内蒙古农业大学张和平教授的研究团队分析了痛风患者和健康人群的肠道菌群结构以及功能,发现痛风患者与健康人群之间肠道微生物的组成和功能特征存在明显的差异,并且基于这些差异建立模型对痛风患者进行早期诊断,准确率高达88.9%[13]。
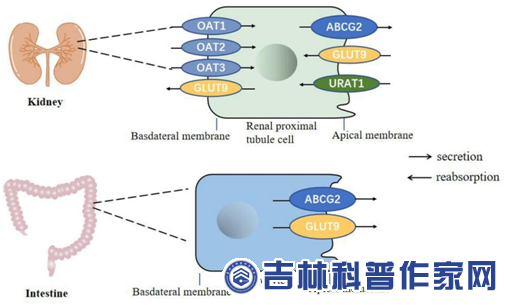
图表 3 肠道与肾脏尿酸代谢关系示意图
Yin H, Liu N, Chen J. The Role of the Intestine in the Development of Hyperuricemia. Front Immunol. 2022 Feb 24;13:845684.
高尿酸血症(HUA)和痛风的发病率正逐年上升,且呈年轻化趋势,已成为重大的公共卫生问题。肠道菌群参与嘌呤代谢酶的合成和炎性细胞因子的释放,其结构变化或失衡可引起代谢紊乱,与代谢性免疫疾病的发生发展密切相关。研究发现,HUA和痛风患者存在肠道菌群失衡。因此,深入研究肠道菌群与HUA和痛风的关系有望使其成为防治相关疾病的靶点。
肠道菌群与痛风之间的强相关性表明肠道细菌的代谢在痛风的诊断和发病机理研究中的重要性。在更大的群体或具有不同种族背景或不同饮食类型的人群中追踪肠道菌群的结构和功能活性将揭示不同个体间肠道菌群的异质性程度,也将为痛风的预防和控制提供新的方法。要将痛风扼杀在摇篮里,让痛风远离我们健康的身体和美好的生活,肠道菌群失调与痛风的关系不可忽视[14]。
本期吉林省科普作家协会为大家带来的是食物与肠道菌群对痛风的影响,下一期将为大家介绍治疗痛风的药物以及青少年痛风该如何诊治,请大家持续关注。
参考文献:
[1]中华医学会,中华医学会杂志社,中华医学会全科医学分会,等. 痛风及高尿酸血症基层诊疗指南(2019年). 中华全科医师杂志,2020,19(04):293-303.
[2]路杰,崔凌凌,李长贵. 原发性痛风流行病学研究进展. 中华内科杂志,2015,54(3):244-247.
[3]Yokose C, McCormick N, Choi HK. The role of diet in hyperuricemia and gout. Curr Opin Rheumatol. 2021 Mar 1;33(2):135-144.
[4]Zhang Y, Chen S, Yuan M, Xu Y, Xu H. Gout and Diet: A Comprehensive Review of Mechanisms and Management. Nutrients. 2022 Aug 26;14(17):3525.
[5]Choi HK, Atkinson K, Karlson EW, Willett W, Curhan G. Purine-rich foods, dairy and protein intake, and the risk of gout in men. N Engl J Med. 2004 Mar 11;350(11):1093-103.
[6]Larsson SC, Carlström M. Coffee consumption and gout: a Mendelian randomisation study. Ann Rheum Dis. 2018 Oct;77(10):1544-1546.
[7]Chen G, Tan ML, Li KK, Leung PC, Ko CH. Green tea polyphenols decreases uric acid level through xanthine oxidase and renal urate transporters in hyperuricemic mice. J Ethnopharmacol. 2015 Dec 4;175:14-20.
[8]Choi HK, Curhan G. Beer, liquor, and wine consumption and serum uric acid level: the Third National Health and Nutrition Examination Survey. Arthritis Rheum. 2004 Dec 15;51(6):1023-9.
[9]Sugie T, Imatou T, Miyazaki M, Une H. The effect of alcoholic beverage type on hyperuricemia in Japanese male office workers. J Epidemiol. 2005 Mar;15(2):41-7.
[10]Nakagawa T, Lanaspa MA, Johnson RJ. The effects of fruit consumption in patients with hyperuricaemia or gout. Rheumatology (Oxford). 2019 Jul 1;58(7):1133-1141.
[11]Kaneko K, Aoyagi Y, Fukuuchi T, Inazawa K, Yamaoka N. Total purine and purine base content of common foodstuffs for facilitating nutritional therapy for gout and hyperuricemia. Biol Pharm Bull. 2014;37(5):709-21.
[12]Teng GG, Pan A, Yuan JM, Koh WP. Food Sources of Protein and Risk of Incident Gout in the Singapore Chinese Health Study. Arthritis Rheumatol. 2015 Jul;67(7):1933-42.
[13]张和平. 痛风患者肠道菌群群落结构的研究[C]/乳酸菌与生物工程:第八届乳酸菌与健康国际研讨会摘要汇编.[出版者不详],2013:19.
[14] Yin H, Liu N, Chen J. The Role of the Intestine in the Development of Hyperuricemia. Front Immunol. 2022 Feb 24;13:845684.
作者简介:
何猛:吉林大学第二医院骨科博士在读。在此次论文中负责前半部分文本的撰写和图片制作。
姬晨清:吉林大学第二医院2018级本科在读。在此次论文中负责前半部分文本的校对。
潘相君:吉林大学第二医院骨科硕士在读。在此次论文中负责后半部分文本的撰写。
于泽豪:吉林大学第二医院骨科硕士在读。在此次论文中负责后半部分文本的图片搜索。
刘世博:吉林大学第二医院骨科硕士在读。在此次论文中负责后半部分文本的校对。
张全超:吉林大学考古学院副院长,教授,博士研究生导师。教育部长江学者青年学者,吉林省长白山学者特聘教授。在此次论文中负责论文的审核与修改。
秦彦国:吉林大学第二医院院长,教授,主任医师,博士研究生导师。荣获“全国抗击新冠肺炎疫情先进个人”称号,入选中组部“万人计划”、科技部中青年科技创新领军人才。在此次论文中负责论文的审核与修改。